En avril 2021, la Direction européenne de la qualité du médicament & soins de santé (EDQM) a indiqué avoir reçu des informations à propos de la possible présence d’impuretés azoturées potentiellement mutagènes dans certaines substances actives de la classe des sartans. Les investigations demandées par l’EDQM ont montré que seules quelques sources étaient concernées. Différentes mesures ont été prises pour éviter la libération sur le marché de toute substance active contenant ces impuretés à une teneur supérieure à la teneur acceptable. Il a, par ailleurs, été demandé à tous les titulaires d’un certificat de conformité aux monographies de la Pharmacopée Européenne (CEP) concernés de prendre les actions correctives nécessaires pour faire en sorte que ces impuretés ne soient pas présentes au-delà des limites acceptables, à l’avenir. L’examen, par l’EDQM, de ces mesures relatives aux sources concernées est terminé pour certains fabricants et bien avancé pour d’autres.
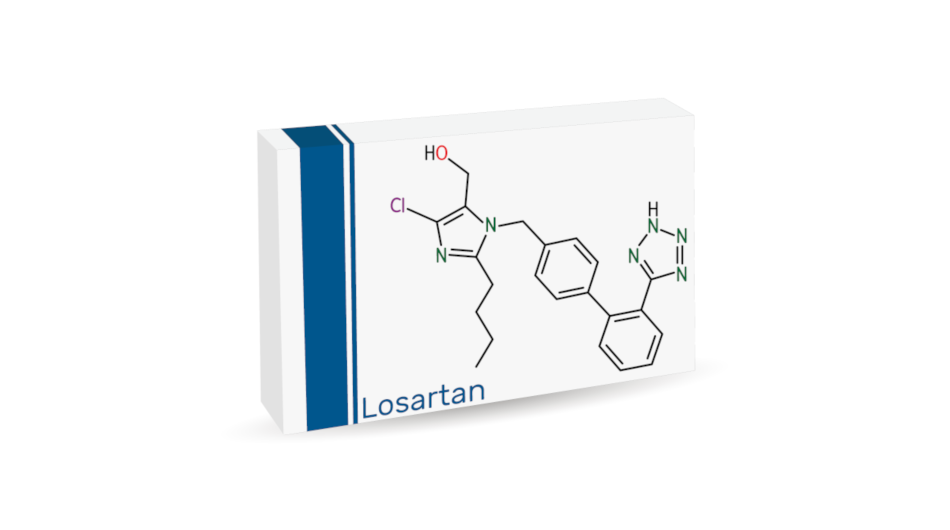
Ces récentes investigations ont permis d’identifier une autre impureté azoturée qui n’a, à ce jour, été détectée que dans le losartan potassique : 5-[4’-[(5-(azidométhyl)-2-butyl-4-chloro-1H-imidazol-1-yl)méthyl]-[1,1’-biphényl]2-yl]-1H-tétrazole (CAS 727718-93-6) (« impureté azoturée de losartan »). Cette impureté a été retrouvée lors d’un essai de mutagénicité bactérienne (test d’Ames).
En l’absence d’informations complémentaires issues d’études in vivo, il est nécessaire de veiller à ce que cette impureté azoturée soit contrôlée à une teneur inférieure ou égale au seuil de préoccupation toxicologique (SPT) (pour en savoir plus, voir le guideline ICH M7). Les sources concernées par ce problème d’azoture ont été identifiées et l’examen, par l’EDQM, de toute action corrective prise par les entreprises en question est terminé ou bien avancé.
Agir sur la présence d’impuretés azoturées dans les substances actives de la classe des sartans – et faire en sorte que les utilisateurs des médicaments concernés soient protégés contre tout risque éventuel – est la plus grande priorité de l’EDQM. Cette dernière prendra donc les mesures qui s’imposent concernant les CEP (p. ex. leur suspension) lorsque leurs titulaires ne sont pas considérés comme totalement engagés envers l’atteinte de ces objectifs.
L’EDQM rappelle à tous les titulaires de CEP qu’ils ont l’obligation de communiquer aux titulaires d’une autorisation de mise sur le marché des informations appropriées en ce qui concerne les impuretés azoturées, ce qui leur permet d’utiliser ces informations pour s’acquitter de leurs responsabilités juridiques.
Voir aussi :