Contrôle des produits autorisés par voie centralisée (CAP)
Ces activités impliquent uniquement les pays du réseau OMCL appartenant à l'UE/EEE
- Contexte réglementaire actuel
- La procédure
- Avantages du programme d’échantillonnage et d’analyse des produits autorisés par voie centralisée (CAP)
- Réalisations en 2024
Contexte réglementaire actuel
Depuis 1995, la Commission des Communautés européennes accorde des autorisations de mise sur le marché communautaire pour les nouveaux médicaments à usage humain ou vétérinaire. Il s'agit des produits autorisés par voie centralisée (CAP, pour "Centrally Authorised Products"). Ces produits peuvent ipso facto être commercialisés sur tout le territoire des États membres de l'UE/EEE. Une approche coordonnée du contrôle qualité de ces produits devient alors nécessaire. En juin 1999, un contrat régissant un programme annuel d'échantillonnage et d'analyse des CAP a été signé par l'Agence européenne des médicaments (EMA) et l'EDQM. L'EMA est le promoteur du programme, dont elle a la responsabilité globale. L'EDQM, quant à elle, coordonne l'échantillonnage et les essais. Elle rend compte des résultats et propose des actions de suivi, si nécessaire, à l'EMA. Les services d'inspection nationaux recueillent des échantillons des produits commercialisés et les membres du réseau OMCL de l'UE/EEE effectuent les essais.
Depuis 2009, tous les programmes annuels incluent des produits sélectionnés selon une approche d’analyse du risque, contre une approche systématique auparavant (chaque programme annuel comprenait les produits ayant obtenu une autorisation de mise sur le marché communautaire trois ans plus tôt).
La procédure
La liste des produits à inclure dans le programme annuel est préparée par le Secrétariat de l'EMA en collaboration avec les comités scientifiques de l'EMA. Elle est transmise à l'EDQM qui coordonne alors les opérations d'échantillonnage et d'analyse sur la base des informations fournies, sur demande de l'EMA, par les titulaires d'autorisation de mise sur le marché (TAMM). Les échantillons sont en principe prélevés tout au long de la chaîne de distribution des médicaments (c.-à-d. auprès des distributeurs en gros et des pharmacies communautaires et hospitalières) par des contacts nationaux désignés pour l'échantillonnage. Les échantillons sont en moyenne prélevés dans trois pays différents. Ils sont envoyés à l'EDQM qui les attribue aux laboratoires nationaux de contrôle qui effectuent les essais conformément à des protocoles bien établis issus des dossiers d'autorisation de mise sur le marché (AMM). L'EDQM recueille les analyses et les résultats et établit un rapport qui comprend les résultats du contrôle de la qualité et, si nécessaire, des propositions de mesures de suivi. Ce rapport est communiqué à l'EMA.
Avantages du programme d’échantillonnage et d’analyse des produits autorisés par voie centralisée (CAP)
Le document "The advantages and benefits of the CAP Surveillance Project" (uniquement en anglais), publié en novembre 2013, met en avant la valeur de cette activité multidisciplinaire. Il comprend en outre une évaluation statistique du programme et une section consacrée à des considérations futures.
CAP : État des lieux 2024
Le programme commun d’échantillonnage et de contrôle des produits autorisés selon la procédure centralisée (CAP) se poursuit pour la 26e année consécutive. Lancé initialement pour couvrir les médicaments pour usage humain ou vétérinaire « classiques » et les génériques, il n’a cessé depuis de s’améliorer et de s’étoffer grâce à l’étroite collaboration entre ses partenaires, notamment avec l’ajout de deux activités de contrôle des CAP en 2019.
Pour le programme classique annuel, une liste de produits à inclure est préparée conjointement par le secrétariat et les comités scientifiques de l’EMA , selon une approche par les risques, avec la contribution du réseau OMCL et de l’EDQM. Quant au programme de surveillance des génériques, il prévoit trois campagnes de contrôle par an.
Le programme classique CAP 2024 a porté sur 36 médicaments pour usage humain (19 produits biologiques, dont 3 à base d’insuline, et 17 produits chimiques) et sur 7 médicaments pour usage vétérinaire (3 produits immunobiologiques et 4 produits chimiques). Cette édition a, par ailleurs, inclus un projet de contrôle de substances actives.
Le programme de surveillance des génériques CAP 2024 a couvert des produits contenant du lénalidomide, du méloxicam et de l’acide zolédronique.
Du fait de l’augmentation des biosimilaires , le programme de surveillance des biosimilaires a compté, en 2024, un nouveau projet. L’adalimumab est ainsi venu s’ajouter au filgrastim, à l’étanercept et le rituximab, sur lesquels avaient porté les trois premiers projets.
Un programme de contrôle des produits faisant l’objet d’une distribution parallèle a été mis en place afin de vérifier l’authenticité des produits sélectionnés. Sept produits ont été contrôlés dans ce cadre en 2024.
Les résultats des programmes 2024 montrent que la grande majorité des produits contrôlés étaient de la qualité attendue et conformes aux spécifications autorisées. Au 31 décembre 2024, aucun résultat hors spécifications n’avait été décelé. En revanche, pour quelques produits, des problèmes d’ordre réglementaire, technique ou rédactionnel ont été signalés et suivis par l’EMA.
Procédure CAP
(Cliquez sur la vignette ci-dessous pour l'agrandir)
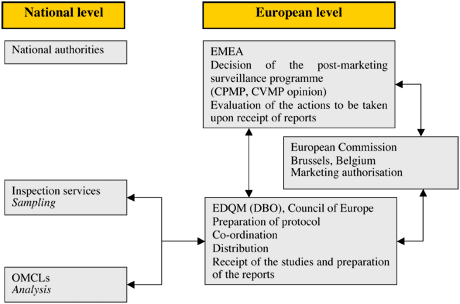
General procedure for S&T CAP regular programme :
- PA/PH/CAP (05) 49 R13 (valid until finalisation of the 2024 CAP programme)
- PA/PH/CAP (05) 49 R14 (only valid as for the 2025 CAP Programmes)
General procedure for the Generics CAP S & T programme : en vigueur à partir de janvier 2025:
General Procedure for the Biosimilars Programme CAP S & T programme : en vigueur à partir de novembre 2025
General procedure for the Parallel Distribution CAP S & T programme: en vigueur à partir de novembre 2025
General Procedure for the CAP Nitrosamines Programme : en vigueur à partir de septembre 2025:



