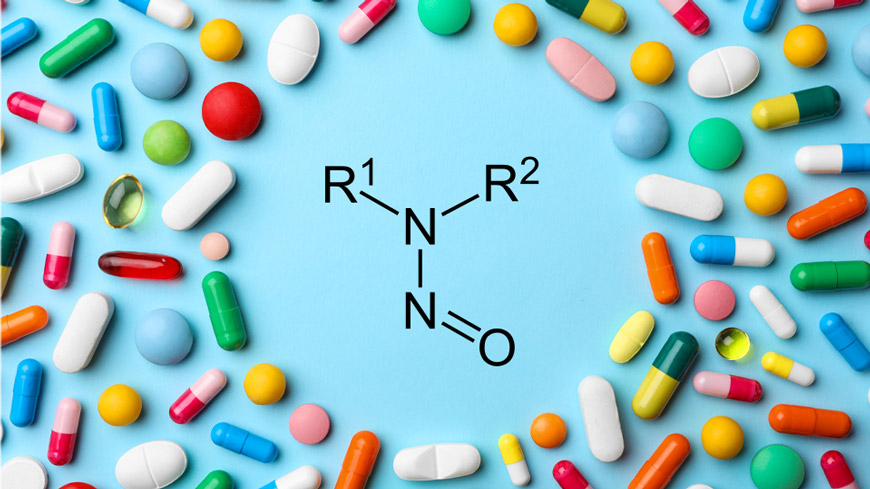
Ces dernières années, les textes de la Pharmacopée Européenne (Ph. Eur.) ont été régulièrement adaptés dans un souci d’harmonisation avec les dernières exigences réglementaires européennes en matière de N-nitrosamines.
Les mesures mises en place à cette fin ont notamment compris l’ajout, dans cinq monographies de « sartans » de la Ph. Eur., d’une déclaration relative à la production couvrant le risque de formation de N-nitrosamines (mise en application rapide en avril 2021), la révision de deux monographies générales majeures, Substances pour usage pharmaceutique (2034) et Préparations pharmaceutiques (2619), dans le but de les harmoniser avec les exigences européennes, et l’élaboration d’un chapitre général, 2.5.42. N-nitrosamines dans les substances actives.
À ce jour, dans les monographies spécifiques de substances actives de la Ph. Eur., deux approches ont été déployées pour agir sur le risque de contamination par des impuretés N-nitrosamines particulières, à savoir l’introduction d’une déclaration dans la section Production de certains textes – comme dans le cas des monographies de « sartans » – et l’ajout d’une spécification dans la section Essai de la monographie. Les monographies de médicaments sont dépourvues de recommandations générales relatives aux impuretés N-nitrosamines.
Lors de sa 176e session (20-21 juin 2023), la Commission européenne de Pharmacopée (EPC) a examiné les approches déployées actuellement, en tenant compte de tous les textes sur les N-nitrosamines existants et, en particulier, des monographies générales Substances pour usage pharmaceutique (2034) et Préparations pharmaceutiques (2619), qui comprennent désormais toutes deux une déclaration au sujet des impuretés N-nitrosamines (voir Supplément 11.3, publié récemment). Elle a décidé, à cette occasion, de revoir la stratégie qu’elle avait initialement adoptée pour le contrôle des N-nitrosamines dans les monographies spécifiques de substances actives et de médicaments.
Concernant les substances actives
L’EPC a donc recommandé de supprimer la section Production couvrant les impuretés N-nitrosamines des monographies spécifiques de substances actives et d’éviter, à l’avenir, d’inclure ce type de déclarations dans de nouvelles monographies, car l’exigence générale relative aux N-nitrosamines qui figure dans la monographie générale 2034 révisée s’applique à tous les ingrédients entrant dans le champ d’application du texte. Cette mesure empêcherait une répétition superflue, assurerait la cohérence entre les monographies et éviterait que l’absence de déclaration de ce genre dans une monographie soit interprétée, à tort, comme une absence de risques.
L’EPC a également proposé de définir des règles claires concernant l’ajout d’une spécification relative aux impuretés N-nitrosamines dans la section Essai des monographies de substances actives. Il a été suggéré qu’il conviendrait d’appliquer ces règles uniquement lorsque la N-nitrosamine considérée est une impureté liée au procédé, c.-à-d. générée pendant la synthèse de la substance, ou une impureté de dégradation résultant de la conservation de la substance. L’essai et la limite seraient inclus dans une monographie spécifique dans les cas où cette impureté a été détectée dans plusieurs sources de la substance et une fois une limite approuvée par les Autorités compétentes ou recommandée par le Non-clinical Working Party (NcWP).
L’EPC a toutefois recommandé de ne pas aborder, dans les monographies spécifiques, les types de contamination potentielle par les N-nitrosamines énumérés ci-après, car ils sont considérés comme couverts par ailleurs :
- les impuretés résultant des pratiques de fabrication pendant la synthèse de la substance active (matières valorisées ou recyclées, contamination croisée) ;
- une impureté N-nitrosamine liée à la substance active, sauf si elle est générée pendant la synthèse de la substance active ou liée à la dégradation de la substance active elle-même ;
- le risque de transformation en une nitrosamine (amines secondaires, p. ex.).
Concernant les monographies de médicaments
Pour ce qui est des monographies de médicaments, l’EPC n’a pas jugé approprié d’introduire de spécification dans la section Essai ni de déclaration dans la section Production, sauf dans des cas spécifiques et justifiés, car le risque de formation des N-nitrosamines dépend, dans une vaste mesure, de la composition du médicament et des conditions dans lesquelles il est fabriqué. Elle considère, en effet, que la section N-nitrosamines de la monographie générale Préparations pharmaceutiques (2619) répond de manière appropriée à ce risque.
Conclusion
L’impact de la stratégie proposée sur les monographies spécifiques de la Ph. Eur. déjà publiées est détaillé dans le tableau suivant.
|
Monographie |
Référence |
Emplacement de la déclaration |
Révision |
|
Clopamide |
01/2017:1747 |
Production |
TECHNIQUE |
|
Gliclazide |
07/2021:1524 |
Essai |
NON |
|
Molsidomine |
01/2017:1701 |
Essai |
NON |
|
Indapamide |
04/2022:1108 |
Essai |
NON |
|
Trolamine |
01/2017:1577 |
Essai |
NON |
|
Daltéparine sodique |
01/2008:1195 |
Production |
TECHNIQUE |
|
Nadroparine calcique |
01/2008:1134 |
Essai |
TECHNIQUE |
|
Valsartan |
04/2021:2423 |
Production |
MINEURE |
|
Candésartan cilexétil |
04/2021:2573 |
Production |
MINEURE |
|
Olmésartan médoxomil |
04/2021:2600 |
Production |
MINEURE |
|
Irbésartan |
04/2021:2465 |
Production |
MINEURE |
|
Losartan potassique |
04/2021:2232 |
Production |
MINEURE |
Pour les monographies n’ayant pas besoin d’être révisées, la spécification pourrait être revue si de nouvelles données en provenance des autorités réglementaires, du NcWP et/ou de fabricants étaient portées à la connaissance de l’EPC, par l’intermédiaire des Autorités nationales de pharmacopées ou de l’EDQM. De même, d’autres monographies seront revues à la lumière des nouvelles informations disponibles et, si cela est nécessaire et justifié, une spécification relative aux N-nitrosamines y sera introduite.
Votre avis nous intéresse
Si la stratégie proposée soulève d’importantes inquiétudes, merci de bien vouloir en faire part au Secrétariat de la Ph. Eur. via le HelpDesk de l’EDQM au plus tard fin septembre 2023, pour que l’EPC puisse en tenir compte.
L’EPC prendra une décision finale concernant sa stratégie en matière d’impuretés N-nitrosamines dans les monographies spécifiques lors de sa session de novembre.