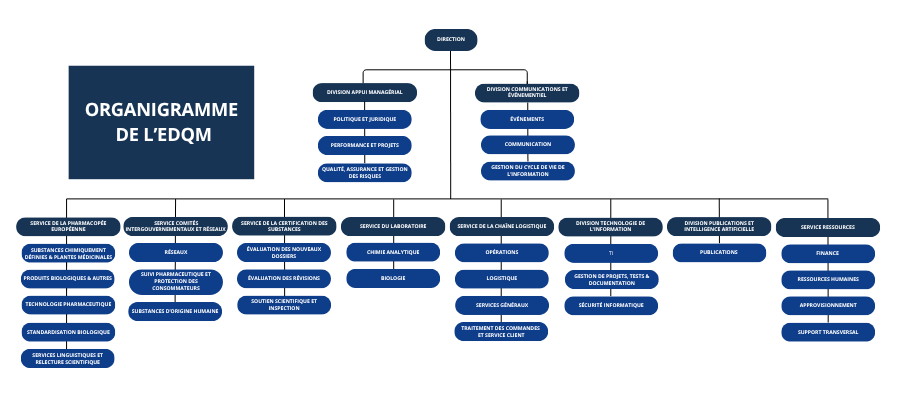
Structure
Qu’est-ce que l’EDQM ?
La Direction européenne de la qualité du médicament & soins de santé (EDQM) est une direction du Conseil de l’Europe.
Elle a été fondée en 1964, lorsque les membres du Conseil de l’Europe – animés par une vision d’harmonisation des normes relatives à la santé et souhaitant faciliter l’entraide et la coopération entre les pays européens – ont adopté la Convention relative à l’élaboration d’une Pharmacopée européenne.
Cette convention prévoyait initialement la création d’un secrétariat technique, dont la taille et les ambitions n’ont cessé de croître au fil du temps. Pour refléter l’élargissement progressif des missions qui lui ont été confiées, à la fois en nombre et en envergure, ce secrétariat a été maintes fois rebaptisé. Aujourd’hui, l’EDQM a la stature d’une entité de premier plan dans le secteur de la protection de la santé publique. Le vaste réseau formé par ses parties intéressées dévouées illustre l’engagement collectif à respecter les normes les plus strictes en la matière.
L’EDQM intervient dans quatre domaines d’action :
- les médicaments,
- les substances d’origine humaine,
- le suivi pharmaceutique,
- la santé des consommateurs et consommatrices.
Elle emploie plus de 400 personnes hautement qualifiées et est composée de dix entités administratives :
Service de la Pharmacopée Européenne
Le Service de la Pharmacopée Européenne (EPD) assure le secrétariat de la Commission européenne de Pharmacopée (EPC). Il est responsable de l’élaboration des textes de la Pharmacopée Européenne (Ph. Eur.) en liaison avec les groupes d’expert·es concernés.
La Ph. Eur. vise à assurer que les médicaments pour usage humain ou vétérinaire sont sans danger et de qualité. Elle rassemble actuellement plus de 3 000 normes qualité officielles et juridiquement contraignantes (appelées « monographies ») applicables aux médicaments et à leurs composants. Les États membres ayant ratifié la Convention relative à l’élaboration d’une Pharmacopée européenne doivent garantir que ces normes sont respectées avant d’autoriser l’utilisation d’un médicament par les patientes et patients. Nombre de pays dans le reste du monde appliquent également ces textes.
Pour élaborer la Ph. Eur., EPD collabore avec un réseau de près de 900 expertes et experts, de toute l’Europe et d’ailleurs, riches d’une solide expérience dans différentes disciplines scientifiques. Ces spécialistes représentent des autorités nationales (autorités de pharmacopée, laboratoires officiels de contrôle des médicaments, autorités d’enregistrement, corps d’inspection, etc.), le secteur privé (industrie pharmaceutique et chimique), des universités ou des instituts de recherche. Le programme de travail de la Ph. Eur. est confié à plus de 60 groupes de travail, qui se réunissent régulièrement tout au long de l’année.
L’EPC, l’organe directeur de la Ph. Eur., tient trois sessions par an, au cours desquelles elle adopte officiellement les textes de la Ph. Eur., mais aussi son programme de travail, et nomme les expertes et experts de la Ph. Eur.
EPD coordonne, par ailleurs, le Programme de standardisation biologique (BSP), qui a pour but d’établir des matériels de référence et d’harmoniser les procédures analytiques pour le contrôle qualité des produits biologiques. Le BSP participe également au développement et à la validation de méthodes alternatives visant à remplacer les essais de laboratoire sur animaux, selon le principe des 3R (remplacement, réduction et raffinement de l’utilisation des animaux à des fins expérimentales).
Service de la Certification des Substances
Le Service de la Certification des Substances (la DCEP) est responsable de la mise en œuvre de la procédure de Certification de conformité aux monographies de la Ph. Eur. (la « procédure de Certification »). Cette procédure a pour but de démontrer que la qualité d’une substance pour usage pharmaceutique est convenablement contrôlée par la monographie correspondante de la Ph. Eur. et qu’elle est conforme aux exigences réglementaires en vigueur.
Reconnus par les autorités nationales d’enregistrement d’Europe et d’ailleurs, les certificats de conformité (CEP) sont utilisés par l’industrie pharmaceutique dans les demandes d’autorisation de mise sur le marché (AMM) des médicaments. La procédure de Certification étant centralisée, les autorités réglementaires et l’industrie réalisent ainsi un gain de temps et de ressources.
Dans le cadre de la procédure de Certification, la DCEP est également chargée de mener des inspections de fabricants de substances actives, dans le but de confirmer que ces substances sont produites conformément aux bonnes pratiques de fabrication et que les informations fournies dans les dossiers de demande de CEP sont exactes. Toutes ces activités se déroulent en liaison avec les Autorités compétentes. En cas de détection de défaut, les inspecteurs et inspectrices assurent le suivi des actions correctives.
La DCEP collabore avec un réseau de près de 150 expert·es (évaluateurs et évaluatrices qualité, inspecteurs et inspectrices) nommé·es par les Autorités nationales compétentes.
Service de la Chaîne logistique
Le Service de la Chaîne logistique (SCD) est responsable de la planification de l’approvisionnement et des opérations (S&OP), de l’approvisionnement scientifique en matières premières, des opérations de fabrication et de logistique (entreposage et expédition), ainsi que du traitement des commandes et des requêtes connexes.
SCD gère, par ailleurs, le catalogue des étalons de référence de la Ph. Eur., des étalons internationaux d’antibiotiques de l’Organisation mondiale de la santé (OMS) et des substances chimiques de référence internationales de l’OMS. Cette tâche implique la classification de l’ensemble des substances utilisées pour leur préparation et la rédaction des fiches de données de sécurité nécessaires.
SCD est également responsable des services généraux de l’EDQM (bâtiments, mobilier, service du courrier, etc.) et de ses systèmes de management de la santé, de la sécurité et de l’environnement.
Service du Laboratoire
Le Service du Laboratoire (la DLab) soutient les travaux de la Ph. Eur. en menant des études analytiques pour établir les étalons de référence, ainsi qu’en contribuant, avec les groupes d’expert·es de la Ph. Eur., à la vérification analytique des textes (monographies ou chapitres généraux) nouveaux ou révisés de la Ph. Eur., dans lesquels ces étalons de référence sont cités.
Les étalons de référence officiels de la Ph. Eur. sont essentiels à la réalisation des essais de contrôle qualité décrits dans les monographies de la Ph. Eur. Ils permettent d’identifier la substance ou le produit pharmaceutique examiné, d’en déterminer la teneur ou l’activité et de contrôler les impuretés potentiellement issues du procédé de fabrication.
La DLab participe également à l’établissement des étalons internationaux d’antibiotiques et des substances chimiques de référence internationales de l’OMS.
L’expertise scientifique et les équipements techniques du Laboratoire de l’EDQM, accrédité ISO 17025:2017, permettent d’assurer aux fabricants et aux laboratoires de contrôle indépendants que l’utilisation des étalons de référence officiels de la Ph. Eur. constitue un moyen fiable de contrôler la qualité des médicaments et de leurs ingrédients.
Service des Comités intergouvernementaux et réseaux
Les missions du Service des Comités intergouvernementaux et réseaux (ICND) couvrent un grand nombre de domaines.
ICND assure le secrétariat de plusieurs comités directeurs chargés de mettre en œuvre des programmes de travail destinés à protéger la santé publique dans différents secteurs. Ces comités ont notamment pour mandat :
- de fournir aux autorités nationales des outils juridiques et des orientations pour les aider à lutter contre la falsification des produits médicaux ;
- d’élaborer des orientations à destination des professionnel·les du suivi pharmaceutique pour promouvoir les connaissances, compétences et valeurs relatives à la pratique et au suivi pharmaceutiques ;
- d’établir des normes qualité spécifiques pour aider les personnels de santé à préparer correctement des médicaments sans AMM adaptés à la population pédiatrique ;
- d’établir des normes d’éthique, de sécurité et de qualité applicables aux substances d’origine humaine utilisées dans un cadre thérapeutique (sang, organes, tissus et cellules, par exemple) ;
- d’élaborer des normes pour améliorer la protection des consommateurs et consommatrices en Europe, notamment dans le domaine des matériaux pour contact alimentaire et des cosmétiques.
Par ailleurs, ICND coordonne les activités de deux réseaux de laboratoires officiels de contrôle importants :
Le réseau OMCL regroupe les laboratoires officiels de contrôle des médicaments (OMCL). Son objectif est d’assurer que la qualité des médicaments pour usage humain ou vétérinaire est constante et de favoriser la reconnaissance mutuelle des résultats des essais de contrôle qualité réalisés par les OMCL, dans un souci d’optimisation de l’utilisation des ressources. Il coordonne des programmes de surveillance du marché indépendants, à l’échelle européenne, afin de contrôler la qualité des médicaments tout au long de leur cycle de vie.
Le réseau OCCL regroupe les laboratoires officiels de contrôle des produits cosmétiques (OCCL), qui contrôlent la qualité et la sécurité d’utilisation des cosmétiques à l’échelle nationale et renforcent leur capacité à protéger les consommateurs et consommatrices en mutualisant connaissances et expertise. Les initiatives coordonnées par le réseau OCCL visent spécifiquement à assurer la sécurité des consommateurs et consommatrices dans toute l’UE, ainsi que la conformité aux dispositions relatives au marché unique de l’UE.
ICND collabore avec environ 1 200 expert·es nommé·es par les États membres.
Division IT
La Division IT (ITD) est chargée de fournir les équipements et services informatiques et d’assurer la sécurité de l’information de l’EDQM, ce qui comprend la gestion de l’ensemble de ses projets informatiques.
ITD gère le développement et la maintenance de bases de données européennes à accès restreint et publiques, comme la base de données Knowledge, le catalogue des SCR, et les bases de données CEP et Melclass. Elle accompagne également la mise en œuvre et la maintenance des applications informatiques à l’échelle de l’EDQM.
Division Publications & IA
La Division Publications & IA (PAID) coordonne les projets de publication de l’EDQM en collaboration avec les services spécialisés de l’EDQM fournissant les textes à publier. Parmi ces projets figurent la Pharmacopée Européenne elle-même et de nombreux guides techniques (notamment sur la transfusion sanguine et sur la transplantation d’organes, de tissus et de cellules). En coopération avec la Direction des technologies de l’information du Conseil de l’Europe, PAID explore les applications potentielles de l’intelligence artificielle à l’EDQM.
Division Communication et événements
La Division Communication et événements (la CED) est responsable de la communication, des relations publiques et des activités de gestion du cycle de vie de l’information de l’EDQM.
Les projets de communication sont menés en collaboration avec les services spécialisés concernés. Ils visent à développer et à entretenir la communication avec les parties intéressées de l’EDQM, ainsi qu’avec les médias d’Europe et d’ailleurs, via le site web, les réseaux sociaux, les publications papier ou électroniques et les campagnes de promotion de l’EDQM.
La CED organise, par ailleurs, toute une série de manifestations : conférences, formations et séminaires, visites des locaux de l’EDQM et de nombreux événements en ligne (webinaires, notamment). Elle représente aussi l’EDQM lors de salons professionnels internationaux et à d’autres occasions.
Au sein de la CED, la section chargée de la gestion du cycle de vie de l’information maintient et développe le système de gestion électronique des documents et des enregistrements (EDRMS), et administre archives papier et projets de numérisation. Elle assure également la gestion de la bibliothèque de l’EDQM, par laquelle un large éventail de publications et de périodiques spécialisés est mis à disposition du personnel de l’EDQM. Enfin, la CED pilote le service d’assistance HelpDesk de l’EDQM, chargé de répondre aux questions des utilisateurs et utilisatrices de l’EDQM tout au long de l’année.
Le Service Ressources
Le Service Ressources (le ResD) est responsable de la gestion administrative et financière de l’EDQM, qui comprend la supervision du budget, la validation des transactions financières et la gestion du recrutement et du développement du personnel, ainsi que du personnel détaché.
Le ResD prépare et assure le suivi des budgets de l’EDQM, valide toutes les demandes financières et traite les demandes de paiement. Elle recense également les immobilisations et les stocks et calcule le coût des activités de l’EDQM.
Le ResD est aussi responsable du traitement des commandes de produits de l’EDQM, de l’émission des factures et du traitement des requêtes connexes.
Par ailleurs chargée des ressources humaines, le ResD organise le recrutement, gère le programme de formation et supervise le processus d’évaluation du personnel de l’EDQM.
Ces activités sont menées en étroite collaboration avec la Direction du Programme et du Budget et la Direction générale de l’administration du Conseil de l’Europe.
Division Appui managérial
La Division Appui managérial (MSD) est chargée de renforcer les cadres stratégiques et opérationnels de l’EDQM. Elle coordonne le développement et la mise en œuvre des stratégies à moyen et à long terme de l’EDQM, assure le suivi et le reporting de l’avancement des programmes et projets stratégiques, et assiste l’équipe de direction de l’EDQM en recueillant des données et en analysant la performance.
MSD fournit également des conseils politiques, notamment en pilotant et en coordonnant l’analyse prospective des sujets émergents dans les domaines réglementaire, politique et technique qui pourraient avoir un impact sur les activités de l’EDQM. En collaboration avec la Direction du Conseil juridique et du Droit international public du Conseil de l’Europe, elle prodigue des conseils juridiques afin de limiter l’exposition de l’EDQM aux risques juridiques.
Au sein de MSD, la Section Management de la Qualité et du Risque (la QARS) coordonne le développement et la maintenance des systèmes de management de la qualité et du risque de l’EDQM, visant à améliorer sans cesse les produits et services de l’EDQM et à assurer la continuité d’activité. Elle est notamment chargée de tenir à jour le registre des risques de l’EDQM.
Dans le cadre des efforts d’amélioration continue déployés par l’EDQM, la QARS coordonne la mise en œuvre des principes ISO 9001, les activités d'accréditation ISO 17025 et réalise des audits internes.
La QARS est également responsable de la libération des étalons de référence produits à l’EDQM.